Что такое хлт в онкологии
Неоадъювантная химиолучевая терапия имеет преимущество в лечении плоскоклеточного рака пищевода. Исследование NEOCRTEC5010
Китайские ученые в Journal of Clinical Oncology опубликовали результаты исследования 3 фазы, согласно которому неоадъювантная химиолучевая терапия (ХЛТ) при местнораспространенном плоскоклеточном раке пищевода имеет преимущество в отношении общей выживаемости (ОВ) по сравнению с оперативным лечением.
В исследовании NEOCRTEC5010 принял участие 451 пациент с потенциально резектабельным плоскоклеточным раком пищевода T1-4N1M0/T4N0M0. Они были рандомизированы в группы неоадъювантной ХЛТ (n=224) или только хирургии (n=227). В первой группе пациенты получали винорелбин 25 мг/м 2 внутривенно дни 1, 8 и цисплатин день 1 или 25 мг/м 2 дни 1-4 каждые 3 недели до 2 циклов с одновременным облучением СОД 40 Гр, РОД 2,0 Гр 5 дней в неделю. В обеих группах пациентам была выполнена эзофагэктомия по McKeown или Ivor Lewis. Первичной конечной точкой была ОВ.
Уровень полных патоморфологических ответов в группе ХЛТ достиг 43,2%. По сравнению с группой хирургии в экспериментальной группе был выше уровень резекций R0 (98,4% против 91,2%; P=0,002). Однако стоит отметить, что только 185 из 224 пациентов (83%) в экспериментальной группе (ХЛТ) были в итоге прооперированы, но в анализ выживаемости вошли все рандомизированные больные. Медиана ОВ была выше в экспериментальной группе (100,1 против 66,5 месяца, отношение рисков 0,71; Р=0,025). То же касалось и медианы безрецидивной выживаемости при R0 резекциях (100,1 против 41,7 месяца; ОР 0,58; Р
Что такое хлт в онкологии
На карциномы в области головы и шеи приходится около 6% всех злокачественных новообразований в мире, частота их возникновения составляет около 7/100 000 случаев в год; из них примерно 75% подвергаются дефинитивному или послеоперативному облучению.
Давно известными «классическими» патогенными факторами является злоупотребление никотином и алкоголем. За последние 30 лет была установлена причинно-следственная связь для определенных подгрупп высокого риска (например, пациенты с ВПЧ-16*-) по увеличению количества случаев диагностики плоскоклеточной карциномы (PEC) ротоглотки (лучший прогноз, особенно в подгруппе некурящих пациентов с наличием ВПЧ [р16] [1]).
Основные принципы лучевой терапии при опухолях в области головы и шеи
Лучевая терапия карцином в области головы и шеи характеризуется высокими дозами облучения и обычно большими объемами лечения в связи с частыми случаями вовлечения путей лимфооттока. Это означает, что лучевая нагрузка будет неизбежно оказана и на многие чувствительные ткани, не пораженные опухолью и расположенные в данной области, особенно слизистые оболочки. Толерантность к лучевой терапии тем ниже,
a) чем выше применяемая доза и
б) чем больше объем облучаемой ткани.
Соответственно, куративная лучевая терапия у пациентов с карциномами в области головы и шеи обычно связана со значительными ранними побочными эффектами (временными, поддающимися лечению), а также поздними побочными эффектами (с тенденцией к персистированию, часто с прогрессированием с течением времени, с проявлением только спустя несколько лет в зависимости от органа). Профили поздних побочных эффектов были значительно сокращены за последние 10-15 лет благодаря технологическим усовершенствованиям в методологии лечения (включая радиотерапию с модуляцией интенсивности, РТМИ), что приводит к более целенаправленному покрытию дозой облучения (=соответствие) области опухоли с одновременным уменьшением дозы облучения в области окружающих тканей, не пораженных опухолью, и соответственно положительным влиянием на восприимчивость к терапии.
Установление показаний для проведения лучевой терапии (с системной терапией или без нее)
В настоящее время при прогрессирующих локорегиональных карциномах в области шеи и головы, как правило, ПКК проводится комбинированное лечение в би- или тримодальном режиме (комбинация хирургического лечения, лучевой терапии, системной терапии). Метод лечения или последовательность терапевтических мероприятий определяется диагнозом, стадией заболевания и индивидуальной клинической картиной пациента (сопутствующая патология, возраст, предпочтения).
Решение о том, какой метод лечения будет применяться и о том, в какой последовательности должны проводиться терапевтические мероприятия, в настоящее время должно приниматься последовательно
Обзор показаний для ЛТ (ХT) при различных типах карцином в области головы и шеи
Диагноз: карцинома в области
Дефинитивная ЛТ
Послеоперационная ЛТ
Начальная
химиолучевая терапия (НХЛТ)
Гортанная часть глотки
возможно сохранение гортани
>pT2, ≥ 2LK+, R1, RR pT2, ≥ 2LK+, R1, RR pT2, ≥ 2LK+, R1, RR T1/2 N0
ХЛТ, при сохранении функция гортани, в противном случае, возможно, операция; решение консилиума
по возможности, нет
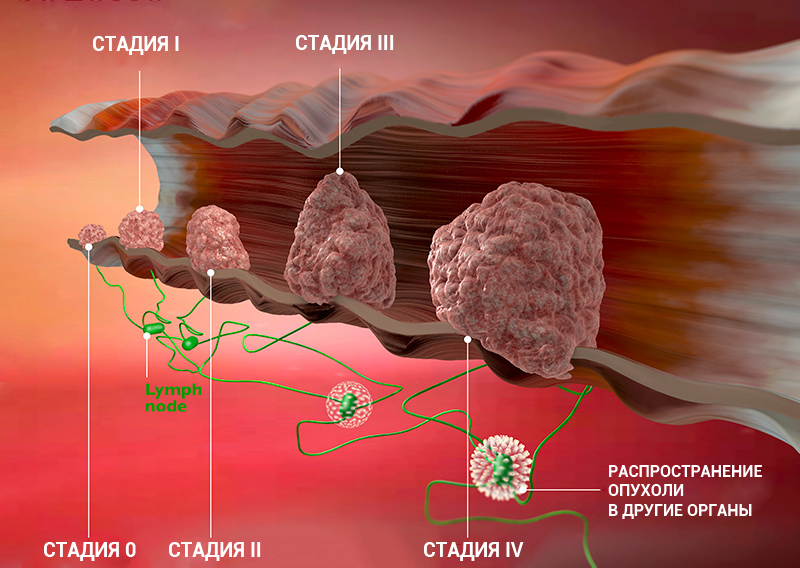
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Одновременная химиолучевая терапия
Определение понятия
Теоретические основы
Из клинических и экспериментальных исследований можно определить следующие преимущества одновременной химиолучевой терапии по сравнению с однократной лучевой терапией или химиотерапией или последовательной комбинацией обоих методов (таблица 1):
Исходя из этих соображений, можно выделит конкретные условия, при которых одновременная химиолучеваятерапия (ХЛТ) кроме лечебной цели имеет еще и теоретическую целесообразность:
Радиобиологические эффекты одновременной химиолучевой терапии
Эффект
Радиационно-биологическое обоснование
Клиническое значение
Аддитивный противоопухолевый эффект
Больший цитотоксический эффект за счет добавления отдельных эффектов лучевой терапии и химиотерапии
Различные точки атаки
Химиотерапия убивает радиорезистентные клетки и наоборот
Химиотерапия может повышать интенсивность внутриклеточного облучения, в частности, например, в гипоксических клетках
Побочные эффекты распространяются на разные системы органов, следует избегать токсических доз соответствующих методов лечения
Интенсификация благодаря более короткому общему времени лечения по сравнению с последовательным проведением химиолучевой терапии
Влияет на пролиферацию опухоли (репопуляцию) во время нескольких недель лучевой- или химиолучевой терапии
Протоколы лечения для одновременной химиолучевой терапии
Основой протоколов клинического лечения обычно является режим лучевой терапии с дозой облучения в диапазоне от 50 до 60 Грей. Следует избегать соответствующего снижения дозы облучения, поскольку химиотерапия не может заменить лучевую терапию. Одновременно с лучевой терапией выполняются инъекции одного или двух цитостатических средств, которые являются наиболее эффективными в соответствующей опухолевой структуре, их вводят в эффективной дозировке, которая также является обычной в случае проведения только химиотерапии. В течение нескольких недель лучевой терапии обычно могут быть проведены два или три курса химиотерапии. При этом выбор наименования и дозировки цитостатиков проходит таким образом, что нет необходимости достигать соответствующих компромиссов в лучевой терапии, являющейся основным терапевтическим элементом.
Клинические результаты и текущий спектр показаний
Превосходство одновременной химиолучевой терапии с применением Цисплатина / 5-фторурацила по сравнению с применением только лучевой терапии при локально прогрессирующих плоскоклеточных карциномах в области головы и шеи
Только лучевая терапия
Одновременная химиолучевая терапия
Клиническая значимость
Локальный контроль опухоли через три года
p Трехлетняя выживаемость
p Результаты рандомизированного исследования отдела радиационной онкологии Немецкого общества борьбы с раковыми заболеваниями (Вендт и др., 1997)
Побочные эффекты и поддерживающая терапия
Согласно имеющимся в настоящее время клиническим данным, по крайней мере, при установленных показаниях (таблица 3) повышенный риск поздних эффектов отсутствует, тем не менее, в данной связи необходимы дальнейшие долгосрочные наблюдения.
Показания к одновременной химиолучевой терапии (ХЛТ), согласно действующим рекомендациям Немецкого общества борьбы с раковыми заболеваниями
Вид опухоли/стадия
Эффект одновременной ХЛТ
Дополнительные методы лечения
Доза облучения
(Гр) /цитостатики
Анальные карциномы, все стадии (плоскоклеточная карцинома, базалоидная карцинома)
Выживаемость, как при радикальном хирургическом лечении, сохранение сфинктера примерно у 80%
Удаление прямой кишки при наличии остаточной опухоли или при рецидиве
около 50Гр / Митомицин С + 5-фторурацил
Прогрессирующие плоскоклеточные карциномы в полости рта и в горле (T3-4 или N3)
Лучшая выживаемость, чем при проведении только лучевой терапии, сохранение органов более чем в 90% случаев
В отдельных случаях операция по поводу остаточной опухоли или рецидива
60-70 Гр / Цисплатин + 5-фторурацил
Локально прогрессирующие карциномы прямой кишки (T4)
Предоперационно для уменьшения размеров опухоли для последующего куративного хирургического лечения
В основном резекция / экстирпация прямой кишки после химиолучевой терапии
Локально прогрессирующие карциномы прямой кишки pT3-4 или pN1-3 после куративного хирургического лечения
Улучшение выживаемости и более оптимальный локальный контроль опухоли с помощью послеоперационной ХЛТ
Дополнительная химиотерапия с 5-фторурацилом до / после ХЛТ
Неоперабельные карциномы мочевого пузыря T3-T4
Выживаемость как при радикальной операции, сохранение мочевого пузыря примерно в 70% случаев
Необходима радикальная цистэктомия при наличии остаточной опухоли или при рецидиве
54-60 Гр / Цисплатин
Неоперабельные карциномы поджелудочной железы
Наиболее эффективная терапия при неоперабельности
Выводы
В целом, результаты клинических исследований, проведенных до настоящего времени, показывают, что при некоторых онкологических заболеваниях оптимальная комбинация лучевой терапии и химиотерапии может обеспечить успешный исход терапии.
Что такое хлт в онкологии
Плоскоклеточный рак является наиболее часто встречающейся злокачественной опухолью полости рта, а в целом к этой локализации относятся: опухоли слизистой губ, дна полости рта, щёк, дёсен, подвижной части языка, твёрдого нёба, а также ретромолярного треугольника. Увы, несмотря на их визуальную доступность, в ранней стадии эти опухоли выявляются лишь у трети больных. Подавляющее большинство на момент диагностики представляют собой местнораспространенный процесс с лимитом 5-летней выживаемости не более 50%. Безусловно, местнораспространные опухоли требуют серьезного, зачастую комплексного подхода к лечению, однако пальма первенства в данном случае принадлежит хирургическому методу, и активная разработка различных видов реконструктивных операций, позволяющих восстановить функцию органа и минимизировать косметический дефект, способствуют этому. Именно с операции принято начинать лечение больных с опухолями полости рта, а затем проводить адъювантное облучение либо химиолучевое лечение при наличии веских факторов риска локорегионарного рецидива. Наиболее типичная лечебная схема может выглядеть следующим образом (таблица 1).
Таблица 1. Группы риска и роль адъювантного облучения или химиотерапии
при плоскоклеточном раке полости рта (Huang, O’Sullivan, 2013) [1].
Безусловно, резектабельность при местнораспространенных опухолях зачастую весьма сомнительна, в ряде случаев оперативное лечение невозможно по причине выраженной сопутствующей патологии или отказа больного. Однако если вести речь о потенциально резектабельных опухолях, возникает вопрос: имеет ли смысл проводить какое-либо неоадъювантное лечение с целью уменьшения опухолевого объема и обеспечения возможности проведения органосохраняющих вмешательств или даже подменять устоявшуюся комбинацию операция – послеоперационная лучевая или химиолучевая терапия самостоятельным радикальным химиолучевым методом при опухолях полости рта? В конце концов, плоскоклеточные карциномы, располагающиеся в паре-тройке сантиметров выше или ниже полости рта (в гортани или носоглотке), могут быть великолепно излечены с помощью только химиолучевого лечения, которое стало стандартным для данных локализаций. Этот факт, наряду с устоявшимся мнением, что проведение неоадъювантной лучевой или химиолучевой терапии более предпочтительно в плане комбинированного или комплексного лечения любых опухолей головы и шеи, видимо, лежит в основе убежденности многих российских радиотерапевтов в необходимости применения именно такой последовательности, в том числе и при опухолях полости рта. В этом мы смогли убедиться во время дискуссии на мастер-классе по оконтуриванию при опухолях головы и шеи. Крупный анализ от американских авторов, опубликованный 20 апреля 2017 года на сайте JAMA Otolaryngology-Head & Neck Surgery, демонстрирует нам свежие данные по этому вопросу [2].
Надо отметить, что в отношении опухолей полости рта крайне мало исследований высокого уровня доказательности, в основном публиковались ретроспективные работы. Рандомизированные исследования относятся в основном к 1990-м годам, а мета-анализов нет вообще. Практически все попытки отсрочить (или избежать) агрессивное хирургическое лечение опухолей данной локализации с помощью активного лучевого или даже химиолучевого лечения обернулись неудачей. В исследовании DOSAK 268 больных местнораспространенным плоскоклеточным раком полости рта или ротоглотки были рандомизированы в группы индукционной химиолучевой терапии с последующей операцией либо только хирургического лечения [3]. Несмотря на то, что риск локального рецидива в группе комплексного лечения был ниже (16% против 31%), общая выживаемость в группе только хирургического лечения оказалась статистически достоверно выше (72% против 81%).
В 2014 году итальянские авторы опубликовали отдаленные результаты мультицентрического рандомизированного исследования (в него включено 198 больных с плоскоклеточным раком полости рта Т2-4 N0-2) по определению эффективности и целесообразности индукционной химиотерапии (3 курса цисплатина с 5-фторурацилом) с последующей операцией и лучевой терапией по сравнению со стандартной схемой комплексного лечения c операцией на 1 этапе [4]. Срок наблюдения составил 11,5 лет, и за этот немалый промежуток времени авторами не было отмечено преимуществ индукционной химиотерапии ни в плане частоты локальных рецидивов и отдаленных метастазов, ни в отношении общей выживаемости, за исключением 22 из 82 (26,8%) оперированных больных из группы индукционной химиотерапии, у которых был достигнут полный патоморфологический ответ. Для них 10-летняя общая выживаемость составила 76,2% против 41,3% у больных без полного регресса опухоли (P=0,0004), однако подавляющее большинство этих пациентов имели ограниченный опухолевый процесс. Частота поздних осложнений была примерно одинакова в обеих группах, хотя у пациентов, начавших лечение с химиотерапии, реже были отмечены дисфагия 2 степени и фиброз.
Шотландское рандомизированное исследование [5] было закрыто раньше времени, продемонстрировав, что самостоятельная лучевая терапия – абсолютно не метод выбора для больных раком полости рта, и облучение должно быть применено на послеоперационном этапе. Общая выживаемость в группе комбинированного лечения с операцией на 1 этапе составила 53% против всего 11% в группе радикальной лучевой терапии. Наконец, в одном из наиболее поздних исследований Iyer et al. 2015 года [6] 119 больных резектабельным раком головы и шеи III/IV стадии, среди которых 27% составили именно пациенты с опухолями полости рта, были рандомизированы либо в традиционную группу операции с последующей лучевой терапией, либо в группу самостоятельного радикального химиолучевого лечения. В целом для всех больных преимущества в отношении общей выживаемости (45% против 35%) и раковоспецифической выживаемости (56% против 46%) были отмечены для группы стандартного лечения, хотя и без статистической достоверности. Что интересно, именно для подгруппы больных с плоскоклеточным раком полости рта эта разница в раковоспецифической выживаемости была не просто наиболее значительна (68% против 12%), но и статистически достоверна (р=0,038). Показатели выживаемости без отдаленных метастазов за 5 лет для них также были значительно и достоверно лучше в группе хирургического лечения (92% против 50%, р=0,05).
Вышеупомянутый анализ Spiotto et al. 2017 года [2] включает в себя наибольшее число больных с плоскоклеточным раком полости рта (6900 пациентов) III/IV стадии, пролеченных в период с 2004 по 2012 гг.; данные взяты из Национальной онкологической базы данных США. Для анализа больные были хорошо сбалансированы в группах по полу, возрасту, расовой принадлежности, наличию сопутствующих заболеваний и др.; кроме того, авторы намеренно исключили из анализа больных с потенциально нерезектабельными N3 и T4b опухолями во избежание некой предвзятости в суждении в отношении прогноза для группы химиолучевого лечения. Из всех больных 4809 прошли через операцию с последующей лучевой терапией (у половины из них облучение сочеталось с химиотерапией), а 2091 получали радикальное химиолучевое лечение.
Полученные результаты подтвердили данные более ранних, как рандомизированных, так и ретроспективных, исследований в отношении общей выживаемости больных плоскоклеточным раком полости рта, только на значительно большем количестве пациентов. Показатели общей выживаемости оказались выше в группе оперативного лечения как для всех больных в целом (3-летняя ОВ: 53,9% против 37,8%; разница – 16,1%; 95% CI 13,6-18,6%), так и при сопоставительном анализе по подгруппам больных со схожими клиническими данными (51,8% против 39,3%; разница – 11,9%; 95% CI 7,8-16,0%). Интересно, что комбинированное или комплексное лечение ассоциировалось с улучшенной выживаемостью среди больных с опухолями T3-T4a (3-летняя ОВ: 49,7% против 36,0%), но не с опухолями T1-T2 (59,1% против 53,5%).
Авторы также отметили, что поскольку показатели выживаемости оказались выше среди больных, оперированных в академических центрах с высоким уровнем хирургической подготовки специалистов, нежели у тех, кто был оперирован в менее крупных онкологических учреждениях, имеет смысл концентрировать этих сложных в хирургическом отношении пациентов именно в крупных центрах для прохождения оперативного этапа лечения.
Эти данные, несмотря на их ретроспективный характер, еще раз подтверждают крайне высокую необходимость адекватного, качественного радикального удаления первичного очага на первом этапе лечения больных плоскоклеточным раком полости рта с последующим адъювантным лучевым или химиолучевым лечением. Без сомнения, в случае местнораспространенного процесса операция зачастую может приводить к утрачиванию органа, значительным функциональным и косметическим дефектам. Как бы кощунственно это ни звучало, именно для этой категории больных сохранение органа не является главной целью, именно для них данный подход может быть оправдан и именно для них высочайшее мастерство хирурга и возможность проведения последующих реконструктивных операций, пожалуй, играют решающую роль. Другие лечебные опции (только лучевое или химиолучевое лечение) пока рассматриваются лишь как методы паллиативного воздействия при абсолютной невозможности операции на первом этапе.